- Home
- Bloguri
- Descopera produse
- Vitamine, minerale si suplimente
- Cuplu si sex
- Produse de slabit
- Medicamente
- Special la Catena
- Tehnico - medicale
- Frumusete si ingrijire
- Mama si copilul
- Acnee
- Diverse
- Nutritie sanatoasa
- Produse naturiste
- Medicamente fertilitate
- Produse BIO
- Idei de cadouri
- NOU la Catena
- Alimente cu destinatie speciala
- Ce Oftapic ti se potriveste
- Adora – Adorabili din prima clipa
- oferte
- card club
- prospecte
- Catalogul lunii
Apidra SoloStar sol.inj 100U/ml x 5pen/3ml
Te asteptam la Catena cu sfaturi si recomandari Alege farmacia
Apidra SoloStar sol.inj 100U/ml x 5pen/3ml - Catena
Fiecare ml contine insulina glulizin 100 Unitati (echivalent cu 3,49 mg).
Fiecare flacon contine solutie injectabila 10 ml, echivalent cu 1000 Unitati.
Insulina glulizin este produsa prin tehnologia ADN-ului recombinant din Escherichia coli.
Indicatii terapeutice
Tratamentul diabetului zaharat la adulti, adolescenti si copii cu varsta de 6 ani sau peste, care necesita tratament cu insulina.
Cititi cu atentie si in intregime acest prospect inainte de a incepe sa luati acest medicament!
|
Denumire |
APIDRA 100U/ml |
|
Descriere |
Tratamentul pacientilor adulti cu diabet zaharat |
|
Denumire comuna internationala |
INSULINUM GLULIZINA |
|
Actiune terapeutica |
INSULINE SI ANALOGI INSULINE SI ANALOGI CU ACTIUNE RAPIDA |
|
Prescriptie |
P-RF - Medicamente si produse medicamentoase care se elibereaza in farmacii pe baza de prescriptie medicala care se retine la farmacie |
|
Forma farmaceutica |
SOL. INJ. IN STILOU INJECTOR PREUMPLUT |
|
Concentratia |
100U/ml |
|
Ambalaj |
Cutie x 5 stilouri injectoare (pen-uri) preumplute (OptiSet®) x 3 ml sol. inj. |
|
Valabilitate ambalaj |
2 ani; dupa prima utilizare: 4 saptamani |
|
Volum ambalaj |
3ml |
|
Cod ATC |
A10AB06 |
|
Firma - Tara producatoare |
SANOFI - AVENTIS DEUTSCHLAND GMBH - GERMANIA |
|
Autorizatie de punere pe piata |
SANOFI - AVENTIS DEUTSCHLAND GMBH - GERMANIA |
1. DENUMIREA COMERCIALA A MEDICAMENTULUI
Apidra 100 unitati/ml solutie injectabila in flacon
2. COMPOZITIA CALITATIVA SI CANTITATIVA
Fiecare ml contine insulina glulizin 100 unitati (echivalent cu 3,49 mg).
Fiecare flacon contine solutie injectabila 10 ml, echivalent cu 1000 unitati.
Insulina glulizin este produsa prin tehnologia ADN-ului recombinant din Escherichia coli.
Pentru lista tuturor excipien?ilor, vezi pct. 6.1.
3. FORMA FARMACEUTICA
Solutie injectabila in flacon Solutie apoasa, incolora, limpede
4. DATE CLINICE
4.1. Indicatii terapeutice
Tratamentul diabetului zaharat la adulti, adolescenti si copii cu vârsta de 6 ani sau peste, care necesita tratament cu insulina.
4.2. Doze si mod de administrare
Potenta acestui preparat este exprimata în unitati. Aceste unitati sunt valabile exclusiv pentru Apidra si nu sunt identice cu UI sau unitatile utilizate pentru a exprima potenta altor analogi de insulina (vezi pct. 5.1).
Apidra trebuie utilizata în regimuri terapeutice care includ o insulina cu durata de actiune intermediara sau prelungita sau analogi de insulina bazala si poate fi utilizata in asociere cu antidiabetice orale.
Doza de Apidra trebuie ajustata individual.
Grupe speciale de pacienti
insuficenta renala
În general, proprietatile farmacocinetice ale insulinei glulizin nu se modifica la pacientii cu insuficenta renala. Cu toate acestea, necesarul de insulina poate fi redus in prezenta insuficientei renale (vezi pct. 5.2)
insuficenta hepatica
Nu s-au efectuat studii privind proprietatile farmacocinetice ale insulinei glulizin la pacientii cu disfunctie hepatica. La pacientii cu insuficienta hepatica, necesarul de insulina poate fi scazut datorita capacitatii reduse de gluconeogeneza si reducerii metabolizarii insulinei.
Vârstnici
La pacientii vârstnici cu diabet zaharat sunt disponibile date farmacocinetice limitate. Deteriorarea functiei renale poate determina reducerea necesarului de insulina.
Copii si adolescenti
Nu exista INFORMATII clinice suficiente cu privire la administrarea Apidra la copii cu vârsta sub 6 ani.
Administrare
Administrare intravenoasa
Apidra poate fi administrata intravenos. Administrarea pe aceasta cale trebuie efectuata de catre personalul medical.
Apidra nu trebuie amestecata cu solutie de glucoza sau solutie Ringer sau cu oricare alta insulina.
Administrare subcutanata
Apidra trebuie administrata sub forma de injectie subcutanata cu putin timp (0–15 min) înainte de masa sau imediat dupa masa sau în perfuzie subcutanata continua cu ajutorul pompei de perfuzie.
Apidra trebuie administrata subcutanat în peretele abdominal, coapsa sau muschiul deltoid sau în perfuzie continua în peretele abdominal. În cadrul aceleiati regiuni (abdomen, coapsa sau muschi deltoid), locurile injectarii si ale perfuzarii trebuie alternate de la o injectie la alta. Viteza absorbtiei si, consecutiv, debutul si durata actiunii, pot fi influentate de locul injectarii, exercitiul fizic si alti factori. Injectarea subcutanata în peretele abdominal asigura o absorbtie putin mai rapida decât de la nivelul altor locuri de injectare (vezi pct. 5.2).
Este necesara prudenta pentru a se asigura ca nu s-a patruns într-un vas de sânge. dupa injectare, locul injectarii nu trebuie masat. Pacientii trebuie instruiti sa foloseasca tehnici corecte de injectare.
În cazul utilizarii în pompa de perfuzie de insulina, Apidra nu trebuie amestecata cu diluanti sau cu oricare alt tip de insulina.
Amestecare cu alte insuline
Atunci când se administreaza sub forma de injectie subcutanata, Apidra nu trebuie amestecata cu niciun alt medicament în afara de insulina umana NPH.
Pentru INFORMATII suplimentare cu privire la manipulare, vezi pct. 6.6.
4.3. Contraindicatii
Hipersensibilitate la substanta activa sau la oricare dintre excipienti
Hipoglicemie
4.4. Atentionari si precautii speciale pentru utilizare
Trecerea unui pacient la un alt tip sau la o alta marca de insulina trebuie facuta sub supraveghere medicala stricta. Modificari în ceea ce priveste concentratia, marca (producatorul), tipul (normala, protamina neutra Hagedorn [NPH], lenta, cu durata lunga de actiune, etc), originea (animala, umana, analog de insulina umana) si/sau metoda de fabricatie pot necesita modificari ale dozei. Poate fi necesara si ajustarea tratamentului antidiabetic oral asociat.
Administrarea unor doze incorecte sau întreruperea tratamentului, mai ales în cazul pacientilor cu diabet insulino–dependent, pot determina hiperglicemie si cetoacidoza diabetica, situatii cu poten?ial letal.
Momentul aparitiei hipoglicemiei depinde de profilul de actiune al insulinelor utilizate si, de aceea, acesta se poate modifica atunci când se schimba regimul terapeutic.
conditiile care pot face ca simptomele precoce de avertizare a hipoglicemiei sa fie diferite sau diminuate includ durata lunga a diabetului zaharat, terapia intensa cu insulina, neuropatia diabetica, medicamentele cum sunt blocantele beta–adrenergice sau dupa trecerea de la o insulina de origine animala la insulina umana.
De asemenea, ajustarea dozei poate fi necesara daca pacientii depun activitate fizica crescuta sau isi modifica regimul alimentar obisnuit. Exercitiul fizic întreprins imediat dupa masa poate creste riscul de hipoglicemie.
dupa o injectie cu analogi cu actiune rapida, hipoglicemia poate sa apara mai devreme decât dupa insulina umana solubila.
reactiile de hipoglicemie sau hiperglicemie necorectate pot determina pierderi ale constientei, coma sau deces.
Necesarul de insulina poate fi modificat în timpul unei afectiuni asociate sau al unor tulburari emotionale.
Acest medicament contine sodiu mai putin de 1 mmol (23 mg) pentru o doza, adica, practic, “nu contine sodiu”.
Apidra contine metacrezol, care poate determina reactii alergice.
4.5. Interactiuni cu alte medicamente si alte forme de interactiune
Nu s-au efectuat studii privind interactiunile farmacocinetice. Pe baza cunostintelor empirice despre medicamente similare, este putin probabil sa apara interactiuni farmacocinetice semnificative clinic.
Numeroase substante modifica metabolizarea glucozei si pot necesita ajustarea dozei de insulina glulizin si o monitorizare deosebit de atenta.
substantele care pot accentua efectul de scadere a glicemiei si pot creste riscul de hipoglicemie includ antidiabeticele orale, inhibitorii enzimei de conversie a angiotensinei (ECA), disopiramida, fibratii, fluoxetina, inhibitorii monoaminoxidazei (IMAO), pentoxifilina, propoxifenul, salicilatii si sulfonamidele antimicrobiene.
substantele care pot reduce efectul de scadere a glicemiei includ glucocorticoizii, danazolul, diazoxidul, diureticele, glucagonul, izoniazida, derivatii de fenotiazin?, somatropina, simpatomimeticele (de exemplu epinefrina [adrenalina], salbutamolul, terbutalina), hormonii tiroidieni, estrogenii, progestogenii (de exemplu din contaceptivele orale), inhibitorii de proteaza si medicamentele antipsihotice atipice (de exemplu olanzapina si clozapina).
Blocantele beta–adrenergice, clonidina, sarurile de litiu sau alcoolul etilic pot fie sa poten?eze, fie sa diminueze efectul insulinei de scadere a glicemiei. Pentamidina poate determina hipoglicemie, care uneori poate fi urmat? de hiperglicemie.
În plus, sub influenta medicamentelor simpatolitice cum sunt blocantele beta–adrenergice, clonidina, guanetidina si rezerpina, semnele reactiei adrenergice compensatorii pot fi reduse sau absente.
4.6. Sarcina si alaptarea
Sarcina
Nu exista date adecvate cu privire la utilizarea insulinei glulizin la femeile gravide.
Studiile privind efectele asupra funcaiei de reproducere efectuate la animale nu au evidentiat nicio diferentq între insulina glulizin si insulina umana în ceea ce priveste sarcina, dezvoltarea embrionara/fetala, parturitia sau dezvoltarea post–natala(vezi pct. 5.3).
Este necesara prudenta atunci când medicamentul se prescrie la femei gravide. Este esentiala monitorizarea atenta a glicemiei.
Este esential pentru pacientele cu diabet zaharat pre-existent sau de sarcina sa mentina un echilibru metabolic bun pe întregul parcurs al sarcinii. Necesitatile de insulina pot sa scada în primul trimestru si, în general, cresc în trimestrele doi si trei. Imediat dupa nastere, necesitatile de insulina scad rapid.
Alaptarea
Nu se cunoaste daca insulina glulizin se excreta în laptele uman, dar, în general, insulina nu se elimina în laptele matern si nu se absoarbe dupa administrare orala.
Mamele care alapteaza pot necesita ajustarea dozei de insulina si a dietei.
4.7. Efecte asupra capacitatii de a conduce vehicule si de a folosi utilaje
Capacitatea de concentrare si de reactie a pacientului pot fi afectate datorita hipoglicemiei, hiperglicemiei sau, de exemplu, datorita tulburarilor vizuale. Aceasta poate constitui un risc în situatiile în care aceste capacitati au o importanta deosebita (de exemplu conducerea unui vehicul sau folosirea utilajelor).
pacientii trebuie atentionati ss-si ia toate masurile de precautie pentru a evita hipoglicemia în timp ce conduc vehicule. Acest aspect este important îndeosebi pentru pacientii la care simptomele de avertizare a hipoglicemiei sunt reduse sau absente sau care au episoade frecvente de hipoglicemie. Trebuie evaluat daca în aceste situatii este posibila conducerea de vehicule sau folosirea de utilaje.
4.8. Reactii adverse
Hipoglicemia, cea mai frecventa reactie adversa la tratamentul cu insulina, poate sa apara daca doza de insulina este prea mare în raport cu necesarul de insulina.
Urmatoarele reactii adverse din studiile clinice sunt enumerate mai jos pe aparate, sisteme si organe, în ordinea scaderii incidentei (foarte frecvente: ≥1/10; frecvente: ≥1/100 si <1/10; mai putin frecvente: ≥1/1000 si <1/100; rare: ≥1/10000 si <1/1000; foarte rare: <1/10000); cu frecventa necunoscuta (care nu poate fi estimat? din datele disponibile).
În cadrul fiecarei grupe de frecventa, reactiile adverse sunt prezentate în ordinea descrescatoare a gravitatii.
|
Baza de date MedDRA pe aparate, sisteme si organe |
Foarte frecvente |
Frecvente |
Mai putin frecvente |
Rare |
|
tulburari metabolice si de nutri?ie |
Hipoglicemie |
|
|
|
|
Afectiuni cutanate si ale tesutului subcutanat |
|
reactii la locul injectarii reactii locale de hipersensibilitate |
|
Lipodistrofie |
|
Tulburari generale si la nivelul locului de administrare |
|
|
reactii sistemice de hipersensibilitate |
|
Tulburari metabolice si de nutritie
În general, simptomele de hipoglicemie apar brusc. Aceastea includ transpiratii reci, piele umeda si palida, fatigabilitate, nervozitate sau tremor, anxietate, senzatie neobisnuita de oboseala sau slabiciune, confuzie, dificultate de concentrare, somnolenta, senzatie de foame excesiva, tulburari vizuale, cefalee, greata si palpitatii. Hipoglicemia poate deveni severa si poate duce la pierderea constientei si/sau convulsii si poate determina afectarea temporara sau permanenta a functiei cerebrale si chiar deces.
Afectiuni cutanate si ale tesutului subcutanat
În timpul tratamentului cu insulina, pot sa apara reactii locale de hipersensibilitate (eritem, edem si prurit la locul injectarii). Aceste reactii sunt de obicei tranzitorii si dispar pe parcursul tratamentului.
Lipodistrofia poate sa apara la locul injectarii ca rezultat al omiterii alternarii locului de injectare din cadrul unei regiuni.
Tulburari generale si la nivelul locului de administrare
reactiile sistemice de hipersensibilitate pot include urticarie, constricaie toracica, dispnee, dermatita alergica si prurit. Cazurile severe de alergie generalizata, incluzând reactia anafilactica, pot pune viata în pericol.
4.9 Supradozaj
Hipoglicemia poate sa apara ca rezultat al unui exces de activitate a insulinei comparativ cu aportul alimentar si consumul energetic.
Nu sunt disponibile date specifice cu privire la supradozajul cu insulina glulizin. Cu toate acestea, hipoglicemia se poate dezvolta în etape consecutive.
Episoadele hipoglicemice usoare pot fi tratate prin administrare orala de glucoza sau produse zaharoase. De aceea, se recomanda ca pacientii diabetici sa aiba întotdeauna la ei zaharului cubic, dulciuri, biscuiti sau suc de fructe îndulcit cu zaharului.
Episoadele severe de hipoglicemie, în care pacientul îsi pierde constienta, pot fi tratate cu glucagon (0,5 mg pâna la 1 mg) administrat intramuscular sau subcutanat de catre o persoana instruita adecvat sau prin administrare intravenoasa de glucoza, de catre un cadru medical. De asemenea, daca pacientul nu raspunde la tratamentul cu glucagon în primele 10 pâna la 15 minute, glucoza trebuie administrata intravenos.
Dupa recapatarea constientei, se recomanda administrarea orala de glucide pentru a preveni recidiva.
Dupa injectarea de glucagon, pacientul trebuie monitorizat în spital, pentru a se depista cauza acestui episod hipoglicemic sever si pentru prevenirea altor episoade similare.
5. PROPRIETAT FARMACOLOGICE
5.1 Proprietati farmacodinamice
Grupa farmacoterapeutica: Insuline si analogi injectabili, cu actiune rapida, codul ATC: A10AB06
Insulina glulizin este un analog recombinant de insulina umana, care este echipotent cu insulina umana regular. Insulina glulizin are debut mai rapid al acaiunii si o durata mai scurta de actiune decât insulina umana regular.
Actiunea principala a insulinei si a analogilor de insulina, inclusiv a insulinei glulizin, este reglarea metabolizarii glucozei. Insulinele scad glicemia prin stimularea captarii periferice a glucozei, mai ales de catre muschii scheletici si tesutul adipos si prin inhibarea glucogenezei hepatice. Insulina inhiba lipoliza în adipocite, inhiba proteoliza si stimuleaza sinteza proteica.
Studiile efectuate la voluntari sanatosi si pacienti cu diabet zaharat au demonstrat ca insulina glulizin are un debut mai rapid al actiunii si o durata mai scurta de actiune decât insulina umana regular, atunci când se administreaza subcutanat. Când insulina glulizin este injectata subcutanat, activitatea de scadere a glicemiei va începe în 10 – 20 de minute. Au fost observate un debut mai rapid si o durata mai scurta de actiune, precum si un vârf de raspuns mai mare dupa administrarea intravenoasa, comparativ cu administrarea subcutanata. Activitatea de scadere a glicemiei a insulinei glulizin si a insulinei umane regular sunt echipotente atunci când acestea sunt administrate pe cale intravenoasa. O unitate de insulina glulizin are aceeati activitate de scadere a glicemiei ca o unitate de insulina umana regular.
Relatia de proportionalitate cu doza
Într-un studiu efectuat la 18 subiecti de sex masculin cu diabet zaharat de tip 1, cu vârsta cuprinsa între 21 si 50 de ani, insulina glulizin a prezentat un efect de scadere a glicemiei, proportional cu doza, în intervalul de doze relevant terapeutic, cuprins între 0,075 si 0,15 unitati/kg si o crestere mai mica decât proportionala a efectului de scadere a glicemiei, pentru doza de ≥0,3 unitati/kg, asemanator insulinei umane.
Efectul insulinei glulizin se instaleaza de aproximativ doua ori mai rapid decât al insulinei umane regular si se încheie cu aproximativ 2 ore mai rapid decât al insulinei umane regular.
Un studiu de faza I efectuat la pacienti cu diabet zaharat de tip 1 a evaluat profilele de scadere a glicemiei ale insulinei glulizin si ale insulinei umane regular, administrate subcutanat în doze de 0,15 unitati/kg, la intervale diferite în relatie cu o masa standard cu durata de 15 minute. Datele au demonstrat ca insulina glulizin administrata cu 2 minute înainte de masa ofera acelasi control glicemic postprandial comparativ cu insulina umana regular administrata cu 30 de minute înainte de masa. Administrata cu 2 minute înainte de masa, insulina glulizin a oferit un control postprandial mai bun decât insulina umana regular administrata cu 2 minute înainte de masa. Insulina glulizin administrata la 15 minute dupa începerea mesei ofera un control glicemic similar cu cel al insulinei umane regular administrata cu 2 minute înainte de masa
Figura 1: Efectul mediu de scadere a glicemiei într-un interval de 6 ore la 20 de pacienti cu diabet zaharat de tip 1. Insulina glulizin administrata cu 2 minute înainte de începerea mesei (GLULISINE pre), comparativ cu insulina umana regular administrata cu 30 de minute înainte de începerea mesei (REGULAR 30 min) (figura 1A) si comparativ cu insulina umana regular administrata cu 2 minute înainte de masa (REGULAR pre) (figura 1B). Insulina glulizin administrata la 15 minute dupa începerea mesei (GLULISINE post), comparativ cu insulina umana regular administrata cu 2 minute înainte de începerea mesei (REGULAR pre) (figura 1C). Pe axa x, zero (sageata) corespunde începerii unei mese cu durata de 15 minute.
Obezitate
Un studiu de faza I cu insulina glulizin, lispro si insulina umana regular, efectuat la o populatie cu obezitate, a demonstrat ca insulina glulizin isi pastreaza actiunea rapida la aceasta populatie. În acest studiu, intervalul pâna la realizarea a 20 % din ASC totala si ASC (0–2 ore), reprezentând activitatea precoce de scadere a glicemiei, au fost de 114 minute si 427 mg/kg în cazul insulinei glulizin, 121 de minute si 354 mg/kg în cazul insulinei lispro, respectiv 150 de minute si 197 mg/kg în cazul insulinei umane regular (vezi figura 2).
Figura 2: Vitezele de perfuzare a glucozei (GIR) dupa injectarea subcutanata 0,3 unitati/kg de insulina glulizin (GLULISINE) sau insulina lispro (LISPRO) sau insulina umana regular (REGULAR) la o populatie cu obezitate.
Un alt studiu de faza I cu insulina glulizin si insulina lispro efectuat la o populatie de 80 de subiecti fara diabet zaharat, cu indici de masa corporala apartinând unui interval larg de valori (18–46 kg/m2) a demonstrat ca actiunea rapida este în general pastrata, pentru valori ale indicilor de masa corporala (IMC) cuprinse într-un interval larg, în timp ce efectul total de scadere a glicemiei scade cu cresterea gradului de obezitate.
Media ASC GIR totala între 0 si 1 ora a fost 102±75 mg/kg si 158±100 mg/kg pentru 0,2, respectiv 0,4 unitati/kg insulina glulizin si a fost de 83,1±72,8 mg/kg si 112,3±70,8 mg/kg pentru 0,2, respectiv 0,4 unitati/kg insulina lispro.
Un studiu de faza I cu insulina glulizin si insulina lispro [IÎ 90%: 0,81, 0,95 (p=<0,01)] efectuat la 18 pacienti obezi cu diabet zaharat tip 2 (IMC cuprins între 35 si 40 kg/m2), a aratat ca insulina glulizin controleaza efectiv variatiile diurne, postprandiale ale glicemiei.
Studii clinice
Diabet zaharat de tip 1–adulti
Într-un studiu clinic de faza III, cu durata de 26 de saptmâni, care compara insulina glulizin cu insulina lispro, ambele administrate subcutanat cu putin timp (0–15 minute) înainte de masa, efectuat la pacienti cu diabet zaharat tip 1 utilizând insulina glargin ca insulina bazala, controlul glicemic al insulinei glulizin a fost comparabil cu cel al insulinei lispro, asa cum reiese din modificarile hemoglobinei glicozilate (exprimata sub forma de HbA1c) de la valoarea initiala pâna la valoarea din momentul atingerii obiectivului final. S-au remarcat valori comparabile ale glicemiei monitorizate de catre pacient. Nu a fost necesara cresterea dozei de insulina bazala în cazul utilizarii insulinei glulizin, spre deosebire de insulina lispro.
Un studiu clinic de faza III, cu durata de 12 saptamâni, efectuat la pacienti cu diabet zaharat de tip 1, carora li s-a administrat insulina glargin ca terapie bazala, demonstreaza ca administrarea insulinei glulizin imediat dupa masa ofera o eficacitate comparabila cu administrarea insulinei glulizin imediat înainte de masa (0–15 minute) sau a insulinei regular (30–45 de minute).
La populatia inclusa în studiu, s-a observat o scadere semnificativa a HbA1c în grupul cu administrare de insulina glulizin înainte de masa, comparativ cu grupul de administrare de insulina regular.
Diabet zaharat de tip 1–Copii si adolescenti
Un studiu clinic de faza III cu durata de 26 de saptamani a comparat insulina glulizin cu insulina lispro, ambele injectate subcutanat imediat înainte de masa (0–15 minute) la copii (4–5 ani: n=9; 6– 7 ani: n=32 si 8–11 ani: n=149) si adolescenti (12–17 ani: n=382) cu diabet zaharat tip 1, carora li se administreaza insulina glargina sau NPH ca insulina bazala. Insulina glulizin a fost comparabila cu insulina lispro din punct de vedere al controlului glicemic, fapt dovedit prin modificarile hemoglobinei glicozilate (HbG exprimata sub forma de HbA1c) de la valoarea initiala pâna la atingerea criteriului final de evaluare si prin automonitorizarea valorilor glicemiei.
Nu exista suficiente date clinice în ceea ce priveste utilizarea Apidra la copii cu vârsta mai mica de 6 ani.
Diabet zaharat tip 2–adulti
S-a efectuat un studiu clinic de faza III cu durata de 26 de saptamâni, urmat de un studiu de siguranta cu durata de 26 de saptamâni pentru a compara insulina glulizin (administrata cu 0–15 minute înainte de masa) cu insulina umana regular (administrata cu 30–45 de minute înainte de masa) ambele injectate subcutanat la pacienti cu diabet zaharat tip 2 carora li se administreaza si insulina NPH ca insulina bazala. Indexul de masa corporala (IMC) mediu al pacientilor a fost de 34,55 kg/m2. S-a demonstrat ca insulina glulizin este comparabila cu insulina umana regular în ceea ce priveste modificarile hemoglobinei glicozilate (exprimata sub forma de HbA1c) de la valoarea initiala pana la valoarea din momentul atingerii obiectivului final la 6 luni (-0,46% pentru insulina glulizin si -0,30% pentru insulina umana regular, p=0,0029) si de la valoarea initiala pana la valoarea din momentul atingerii obiectivului final la 12 luni (-0,23% pentru insulina glulizin si -0,13% pentru insulina umana regular, diferenta nefiind semnificativa). În cadrul acestui studiu, majoritatea pacientilor (79%) au amestecat insulina cu actiune rapida cu insulina NPH imediat înainte de injectare, iar la 58% dintre subiecti utilizau antidiabetice orale la randomizare si au fost instruiti sa continue sa le utilizeze, în aceeati doza.
Rasa si sex
În studiile clinice controlate, efectuate la adulti, insulina glulizin nu a demonstrat diferente privind siguranta si eficacitatea în subgrupele analizate în functie de rasa si sex.
5.2. Proprietati farmacocinetice
În cazul insulinei glulizin, înlocuirea aminoacidului asparagina din insulina umana din pozitia B3 cu lizina si a lizinei din pozitia B29 cu acid glutamic, favorizeaza o absorbtie mai rapida.
Într-un studiu efectuat la 18 subiecti de sex masculin cu diabet zaharat de tip 1, cu vârsta cuprinsa între 21 si 50 de ani, insulina glulizin a prezentat un efect proportional cu doza pentru o expunere initiala, maxiam si totala, la doze cuprinse între 0,075 si 0,4 unitati/kg.
Absorbtie si biodisponibilitate
Profilele farmacocinetice la voluntari sanatosi si la pacienti cu diabet zaharat (tip 1 sau 2) au demonstrat ca absorbtia de insulina glulizin a fost de doua ori mai rapida, iar concentratia plasmatica maxiam de aproximativ doua ori mai mare, comparativ cu insulina umana regular.
Într-un studiu efectuat la pacienti cu diabet zaharat de tip 1, dupa administrarea subcutanata de 0,15 unitati/kg, Tmax pentru insulina glulizin a fost de 55 de minute, iar Cmax de 82 ± 1,3 µunitati/ml, comparativ cu Tmax de 82 de minute si Cmax de 46 ± 1,3 µunitati/ml pentru insulina umana regular. Timpul mediu de rezidenta al insulinei glulizin a fost mai scurt (98 min) decât cel al insulinei umane regular (161 min) (vezi figura 3).
Figura 3: Profilul farmacocinetic al insulinei glulizin si al insulinei umane regular la pacientii cu diabet zaharat de tip 1 dupa o doza de 0,15 unitati/kg.
Într-un studiu efectuat la pacienti cu diabet zaharat de tip 2, dupa administrarea subcutanata a 0,2 unitati/kg de insulin? glulizin, Cmax a fost de 91 µunitati/ml cu un interval interquartil cuprins între 78 pana la 104 µunitati/ml.
În cazul în care insulina glulizin s-a administrat subcutanat în abdomen, muschiul deltoid sau coapsa, curbele concentratiei în functie de timp au fost similare, cu o absorbtie usor mai rapida în cazul administrarii în abdomen, comparativ cu administrarea în coapsa. Absorbtia din deltoid a fost între cele doua valori (vezi pct. 4.2). Biodisponibilitatea absoluta (70%) a insulinei glulizin a fost aceeati indiferent de locul injectarii si a avut o variabilitate intraindividuala scazuta (11%CV). Administrarea de insulina glulizin în bolus intravenos a determinat o expunere sistemica mai mare atunci când a fost comparata cu injecaia subcutanata, cu Cmax de aproximativ 40 de ori mai mare.
Obezitate
Un alt studiu de faza I cu insulina glulizin si insulina lispro, efectuat la o populatie de 80 de subiecti fara diabet zaharat, cu indici de masa corporala apartinând unui interval larg de valori (18–46 kg/m2), a demonstrat ca absorbtia rapida si expunerea totala sunt, în general, pastrate, pentru valori ale indicilor de masa corporala cuprinse într-un interval larg.
Timpul pana la 10% din expunerea totala la INS a fost atins mai repede cu aproximativ 5–6 min cu insulina glulizin.
Distributie si eliminare
Dupa administrarea intravenoasa, distributia si eliminarea insulinei glulizin si ale insulinei umane regular sunt asemanatoare, cu volume de distributie de 13 l si, respectiv, de 22 l si timpi de înjumatatire plasmatica de 13 minute, respectiv 18 minute.
Dupa administrarea subcutanata, insulina glulizin se elimina mai rapid comparativ cu insulina umana regular, cu un timp aparent de injumatatire plasmatica de 42 de minute, comparativ cu 86 de minute. Într-o analiza transversala a studiilor cu insulina glulizin, efectuate atât la voluntari sanatosi, cât si la pacienti cu diabet zaharat de tip 1 sau 2, timpul de injumatatire aparent s-a situat într-un interval interquartil de 37 pana la 75 de minute.
Insulina glulizin a demonstrat o legare de proteinele plasmatice în proportie mica, similar insulinei umane.
Grupe speciale de pacienti
Insuficienta renala
Într-un studiu clinic efectuat la subiecai fara diabet zaharat, cu diferite stadii ale functiei renale (clearance al creatininei >80 ml/min, 30–50 ml/min, <30 ml/min), proprietatile insulinei glulizin de a acaiona rapid au fost, în general, pastrate. Cu toate acestea, necesitatile de insulina pot fi reduse în cazul prezentei insuficientei renale.
Insuficenta hepatica
Proprietatile farmacocinetice nu au fost investigate la pacientii cu insuficenta hepatica.
Vârstnici
Exista date farmacocinetice foarte limitate la pacientii vârstnici cu diabet zaharat.
Copii si adolescenti
Au fost efectuate studii privind proprietatile farmacocinetice si farmacodinamice ale insulinei glulizin la copii (7–11 ani) si la adolescenti (12–16 ani) cu diabet zaharat de tip 1. Insulina glulizin a fost absorbita rapid la ambele grupe de vârsta, cu Tmax ?i Cmax similare cu cele de la adulti (vezi pct. 4.2). În cazul administrarii imediat înaintea unei mese test, insulina glulizin ofera un control postprandial mai bun decât insulina umana regular, la fel ca în cazul pacientilor adulti (vezi pct. 5.1). Curba glicemiei (ASC0-6h) a fost de 641 mg.ora/dl în cazul insulinei glulizin si de 801 mg.ora/dl în cazul insulinei umane regular.
5.3. Date preclinice de siguranta
Datele non–clinice nu au relevat alte semne de toxicitate, diferite fata de cele ale insulinei umane regular sau semnificative clinic la om, în afara de cele legate de activitatea farmacodinamica de scadere a glicemiei (hipoglicemie).
6. PROPRIETATI FARMACEUTICE
6.1 Lista excipientilor
Metacrezol
Clorura de sodiu
Trometamol
Polisorbat 20
Acid clorhidric concentrat
Hidroxid de sodiu
Apa pentru preparate injectabile
6.2 Incompatibilitati
Administrare subcutanata
In absenta studiilor de compatibilitate, acest medicament nu trebuie amestecat cu niciun alt medicament în afara de insulina umana NPH.
În cazul utilizarii unei pompe de perfuzie de insulina, Apidra nu trebuie amestecata cu alte medicamente.
Administrare intravenoasa
S-a dovedit ca Apidra este incompatibila cu solutia de glucoza 5 % si solutia Ringer si, prin urmare, nu trebuie utilizata impreuna cu aceste solutii. Utilizarea împreuna cu alte solutii nu a fost studiata.
6.3 Perioada de valabilitate
2 ani
Perioada de valabilitate dupa prima utilizare a flaconului
Medicamentul poate fi pastrat timp de maxim 4 saptamâni, la temperaturi sub 25°C, la distanta de caldura sau lumina directe. A se tine flaconul în cutie pentru a pentru a fi protejat de lumina.
Se recomanda ca data primei utilizari din flacon sa fie notata pe eticheta.
Perioada de valabilitate pentru administrarea intravenoasa
Insulina glulizin pentru utilizare intravenoasa, cu concentratia de 1 Unitate/ml, este stabila la temperaturi cuprinse între 15 C si 25 C timp de 48 ore (vezi pct. 6.6).
6.4 Precautii speciale pentru pastrare
Flacoanele nedeschise
A se pastra la frigider (2°C – 8°C).
A nu se congela.
A nu se pune Apidra langa peretii congelatorului sau pachetul cu lichid de congelare din lada frigorifica.
A se tine flaconul în cutie pentru a fi protejat de lumina.
Flacoanele deschise
Pentru conditii de pastrare, vezi pct. 6.3.
6.5. Natura si continutul ambalajului
10 ml solutie în flacon (din sticla incolora tip I) cu dop (din cauciuc elastomeric clorobutilic cu sigiliu din aluminiu) si capsa detasabila din polipropilena. Sunt disponibile ambalaje cu 1, 2, 4 si 5 flacoane.
Este posibil ca nu toate marimile de ambalaj sa fie comercializate.
6.6. Precautii speciale pentru eliminarea reziduurilor si alte instrucaiuni de manipulare
Administrare subcutanata
Flacoanele de Apidra sunt destinate utilizarii cu seringi pentru insulin?, cu scal? de unitati corespunzatoare si cu pompe pentru insulina (vezi pct. 4.2).
Înainte de utilizare, flaconul trebuie inspectat vizual. Trebuie utilizat numai daca solutia este limpede, incolora, fara particule solide vizibile. Deoarece Apidra este o solutie, nu necesita agitare înaintea utilizarii.
Amestecare cu alte insuline
În cazul amestecarii cu insulina umana NPH, Apidra trebuie prima extrasa în seringa. Injectia trebuie administrata imediat dupa amestecare, deoarece nu exista INFORMATII cu privire la amestecurile constituite cu mult timp înainte de injectare.
Pompa de perfuzie subcutanata continua
Apidra poate fi utilizata pentru perfuzie subcutanata continua de insulina (PSCI) în pompe adecvate pentru perfuzii de insulina, cu catetere si rezervoare corespunzatoare.
Pacientii care folosesc PSCI vor fi instruiti adecvat pentru folosirea sistemului de pompe. Setul de perfuzie si rezervorul trebuie schimbate la intervale de 48 de ore, utilizând o tehnica aseptica.
Pacientii carora li se administreaza Apidra prin PSCI trebuie sa dispuna de o alternativa de administrare a insulinei în cazul unor disfunctionalitati ale pompei.
Administrare intravenoasa
Apidra trebuie utilizata la o concentratie de 1 Unitate/ml insulina glulizin în sisteme de perfuzie cu solutie perfuzabila de clorura de sodiu 9 mg/ml (0,9%) cu sau fara clorura de potasiu 40 mmol/l, utilizând pungi pentru perfuzie din plastic poliamida/poliolefin coextrudat, cu o linie dedicata pentru perfuzie. Insulina glulizin pentru administrare intravenoasa, cu concentratia de 1 Unitate/ml, este stabila la temperatura camerei timp de 48 ore.
Dupa diluare pentru administrare intravenoasa, solutia trebuie sa fie inspectata vizual pentru particule înainte de administrare. Trebuie utilizata numai daca solutia este limpede si incolora, daca nu este tulbure sau cu particule solide vizibile.
S-a dovedit ca Apidra este incompatibila cu solutia de glucoza 5 % si solutia Ringer si, prin urmare, nu trebuie utilizata împreuna cu aceste solutii. Utilizarea împreuna cu alte solutii nu a fost studiata.
Producator: SANOFI
*Pentru pret te asteptam in cea mai apropiata farmacie Catena
CELE MAI RECENTE ARTICOLE
-
Xantopsie – cauze, simptome si tratamentTimp de citire: 6 minute, 59 secunde2 aprilie 2025
Xantopsia este o tulburare de vedere in care pacientii percep obiectele in nuante de galben sau auriu. Aceasta afectiune poate fi asociata si cu alte tulburari oculare, cum ar fi cataracta, degenerescenta…
-
Calmarea tusei seci la copii: ghid complet pentru parintiTimp de citire: 6 minute, 0 secunde2 aprilie 2025
Tusea seaca este o problema comuna de sanatate in randul copiilor, de obicei mai mult suparatoare decat grava. Cu toate acestea, este firesc ca parintii sa se preocupe de gasirea unor remedii pentru calmarea…
-
Tranzitia de la alaptat la biberon: sfaturi si trucuri pentru o trecere linaTimp de citire: 6 minute, 15 secunde1 aprilie 2025
Fiecare etapa din viata bebelusului vine cu provocari noi pentru parinti, iar una dintre ele este tranzitia de la alaptat la biberon. Fie ca este vorba despre intoarcerea mamei la serviciu, despre nevoia…
-
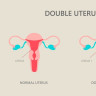
Uter didelf (uter dublu)Timp de citire: 5 minute, 42 secunde1 aprilie 2025
Uterul didelf, cunoscut si sub denumirea de uter dublu, este o anomalie congenitala rara a sistemului reproducator feminin, in care o femeie are doua cavitati uterine separate, fiecare cu propriul sau…
DESCOPERA PRODUSE
- Medicamente
- Medicamente fertilitate
- Special la Catena
- Idei de cadouri
- Produse de slabit
-
Vitamine, minerale si suplimente
- Vitamine si minerale
- Pentru copii
- Multivitamine
- Stres si somn
- Probiotice
- Memorie
- Imunitate
- Afectiuni cardiovasculare
- Tulburari digestive
- Pentru sportivi
- Regenerare si tonifiere
- Alergii
- Circulatie periferica deficitara
- Diabet
- Infectii urinare
- Raceala si gripa
- Sanatatea femeii
- Antioxidante
- Afectiuni osteoarticulare si musculare
- Ingrijirea si sanatatea ochilor
- ORL
- Frumusete si ingrijire
- Acnee
- Cuplu si sex
- Mama si copilul
- Produse BIO
- Produse naturiste
- Tehnico - medicale
- Diverse
- Alimente cu destinatie speciala
- NOU la Catena
- Nutritie sanatoasa
- Ce Oftapic ti se potriveste
- Adora – Adorabili din prima clipa
CONTACT