- Home
- Bloguri
- Descopera produse
- Vitamine, minerale si suplimente
- Cuplu si sex
- Produse de slabit
- Medicamente
- Special la Catena
- Tehnico - medicale
- Frumusete si ingrijire
- Mama si copilul
- Acnee
- Diverse
- Nutritie sanatoasa
- Produse naturiste
- Medicamente fertilitate
- Produse BIO
- Idei de cadouri
- NOU la Catena
- Alimente cu destinatie speciala
- Ce Oftapic ti se potriveste
- Adora – Adorabili din prima clipa
- oferte
- card club
- prospecte
- Catalogul lunii
Fluenz spray nazal suspensie x 1 pulverizator X 0,2 ml
Din pacate, stocul pentru produsul rezervat este momentan epuizat. Din acest motiv rezervarea dumneavoastra nu poate fi finalizata. Multumim!
Fluenz spray nazal suspensie x 1 pulverizator X 0,2 ml - Catena
Fluenz spray nazal, suspensie. Fluenz nu trebuie injectat.
Vaccin gripal (viu atenuat, administrat pe cale nazala)
Acest vaccin respecta recomandarile OMS (pentru emisfera nordica) si decizia UE pentru sezonul 2024/2025.
Acest vaccin poate contine urme reziduale din urmatoarele substante: proteine din ou (de exemplu, ovalbumina) si gentamicina. Cantitatea maxima de ovalbumina este mai mica de 0,024 micrograme per doza de 0,2 ml (0,12 micrograme per ml).
Indicatii
Profilaxia gripei la copii si adolescenti cu varsta cuprinsa intre 24 de luni si mai putin de 18 ani.
Utilizarea Fluenz trebuie sa se bazeze pe recomandarile oficiale
Contraindicatii
• Hipersensibilitate la substantele active, la oricare dintre excipientii enumerati la pct. 6.1 (de exemplu, gelatina) sau la gentamicina (pot exista urme reziduale).
• Reactie alergica severa (de exemplu anafilaxie), la oua sau la proteinele din ou (de exemplu, ovalbumina).
• Copii si adolescenti cu imunodeficienta clinica datorata unor afectiuni sau terapiei imunosupresoare, cum sunt leucemii acute si cronice, limfom, infectie simptomatica cu HIV, deficiente ale imunitatii celulare si doze mari de corticosteroizi. Nu este contraindicata utilizarea Fluenz la persoane cu infectie asimptomatica cu HIV; sau la persoane carora li se administreaza corticosteroizi de uz topic/pe cale inhalatorie sau doze mici de corticosteroizi pe cale sistemica sau la cele carora li se administreaza corticosteroizi ca terapie de substitutie, de exemplu pentru insuficienta suprarenala.
• Copii si adolescenti cu varsta sub 18 ani carora li se administreaza tratament cu salicilati, datorita asocierii sindromului Reye cu administrarea de salicilati in cursul infectiei cu tulpini de virus gripal de tip „salbatic”.
DENUMIREA COMERCIALA A MEDICAMENTULUI
Fluenz spray nazal, suspensie
Vaccin gripal (viu atenuat, administrat pe cale nazala)
Compozitia calitativa si cantitativa
Virus gripal reasortant* (viu atenuat) apartinand urmatoarelor trei tulpini**:
A/Victoria/4897/2022 (H1N1)pdm09 - tulpina similara
(A/Norway/31694/2022, MEDI 369815) 107,0±0,5 UFFF***
A/Thailand/8/2022 (H3N2) - tulpina similara
(A/Thailand/8/2022, MEDI 370626) 107,0±0,5 UFFF***
B/Austria/1359417/2021 - tulpina similara
(B/Austria/1359417/2021, MEDI 355292) 107,0±0,5 UFFF***
.................................................................................................................. per doza de 0,2 ml
* cultivat pe oua fertilizate de gaina, provenite din colectivitati de gaini sanatoase.
** produs in celule VERO prin tehnologie genetica care utilizeaza tehnici de revers transcriere.
Acest medicament contine organisme modificate genetic (OMG).
*** Unitati Formatoare de Focare Fluorescente.
Acest vaccin respecta recomandarile OMS (pentru emisfera nordica) si decizia UE pentru sezonul 2024/2025.
Acest vaccin poate contine urme reziduale din urmatoarele substante: proteine din ou (de exemplu, ovalbumina) si gentamicina. Cantitatea maxima de ovalbumina este mai mica de 0,024 micrograme per doza de 0,2 ml (0,12 micrograme per ml).
Pentru lista tuturor excipientilor, vezi pct. 6.1.
Forma farmaceutica
Spray nazal, suspensie
Suspensia este incolora pana la galben pal, limpede pana la opalescenta cu un pH de aproximativ 7,2. Poate prezenta mici particule albe.
Date clinice
Indicatii terapeutice
Profilaxia gripei la copii si adolescenti cu varsta cuprinsa intre 24 de luni si mai putin de 18 ani. Utilizarea Fluenz trebuie sa se bazeze pe recomandarile oficiale.
Doze si mod de administrare
Doze
Copii cu varsta de 24 de luni si peste si adolescenti
0,2 ml (cate 0,1 ml in fiecare nara).
La copiii care nu au fost vaccinati anterior impotriva gripei sezoniere, trebuie administrata o a doua doza, dupa un interval de cel putin 4 saptamani.
Fluenz nu trebuie utilizat la sugari si copii cu varsta sub 24 de luni, din cauza ingrijorarilor privind siguranta in ceea ce priveste ratele crescute de spitalizare si wheezing la aceasta populatie (vezi pct. 4.8).
Mod de administrare
Imunizarea trebuie sa se efectueze prin administrare pe cale nazala.
Fluenz nu trebuie injectat
Fluenz se administreaza in doze divizate, in ambele nari. Dupa administrarea unei jumatati de doza intr-o nara, se administreaza imediat sau la scurt timp dupa a doua jumatate de doza in cealalta nara. Pacientul poate respira normal in timp ce vaccinul este administrat – nu este nevoie ca doza sa fie inhalata activ sau aspirata.
Vezi pct. 6.6 pentru instructiunile de administrare.
Contraindicatii
- Hipersensibilitate la substantele active, la oricare dintre excipientii enumerati la
pct. 6.1 (de exemplu, gelatina) sau la gentamicina (pot exista urme reziduale).
- Reactie alergica severa (de exemplu anafilaxie), la oua sau la proteinele din ou (de exemplu, ovalbumina).
- Copii si adolescenti cu imunodeficienta clinica datorata unor afectiuni sau terapiei imunosupresoare, cum sunt leucemii acute si cronice, limfom, infectie simptomatica cu HIV, deficiente ale imunitatii celulare si doze mari de corticosteroizi. Nu este contraindicata utilizarea Fluenz la persoane cu infectie asimptomatica cu HIV; sau la persoane carora li se administreaza corticosteroizi de uz topic/pe cale inhalatorie sau doze mici de corticosteroizi pe cale sistemica sau la cele carora li se administreaza corticosteroizi ca terapie de substitutie, de exemplu pentru insuficienta suprarenala.
- Copii si adolescenti cu varsta sub 18 ani carora li se administreaza tratament cu salicilati, datorita asocierii sindromului Reye cu administrarea de salicilati in cursul infectiei cu tulpini de virus gripal de tip „salbatic”.
1.1 Atentionari si precautii speciale pentru utilizare
Trasabilitatea
Pentru a imbunatati trasabilitatea medicamentelor biologice, numele si numarul de lot ale medicamentului administrat trebuie inregistrate in mod clar.
Ca in cazul majoritatii vaccinurilor, totdeauna trebuie sa fie disponibil un tratament medical adecvat pentru abordarea terapeutica corespunzatoare a unei eventuale reactii anafilactice determinate de administrarea Fluenz.
Fluenz nu trebuie administrat copiilor si adolescentilor cu astm bronsic sever sau wheezing activ, deoarece nu s-au efectuat studii clinice adecvate in cazul acestor grupuri de pacienti.
Persoanele carora li se administreaza vaccinul trebuie informate ca Fluenz este un vaccin care contine un virus viu, atenuat si ca exista posibilitatea de transmitere a acestui virus la persoanele imunocompromise. Persoanele carora li se administreaza vaccinul trebuie sa evite, pe cat posibil, contactul apropiat cu persoane care sunt sever imunocompromise (de exemplu, persoane carora li se face un transplant de maduva osoasa si care necesita izolare) timp de 1 – 2 saptamani dupa vaccinare. In studiile clinice, rata maxima de excretie a virusului vaccinal a fost observata dupa 2 – 3 zile de la vaccinare. In situatiile in care nu poate fi evitat contactul cu persoanele care sunt sever imunocompromise, trebuie evaluat riscul potential de transmitere a virusului din acest vaccin gripal, comparativ cu riscul infectarii cu virusul gripal de tip „salbatic” si de transmitere a acestei infectii.
Fluenz nu trebuie in niciun caz injectat.
Nu exista date cu privire la siguranta administrarii intranazale a Fluenz la copiii cu malformatii craniofaciale necorectate.
1.2 Interactiuni cu alte medicamente si alte forme de interactiune
Fluenz nu trebuie administrat copiilor si adolescentilor carora li se administreaza tratament cu salicilati (vezi pct. 4.3). Timp de 4 saptamani dupa vaccinare, nu trebuie administrati salicilati copiilor si adolescentilor, cu exceptia cazului in care este indicat din punct de vedere medical, deoarece a fost observata aparitia sindromului Reye in cazul utilizarii salicilatilor in cursul infectiei cu tulpini de virus gripal de tip „salbatic”.
A fost studiata administrarea concomitenta a Fluenz cu urmatoarele vaccinuri vii atenuate: rujeolic, urlian, rubeolic, varicelic si vaccin cu virus poliomielitic administrat pe care orala. Nu s-au observat modificari clinice semnificative ale raspunsului imun la vaccinul rujeolic, urlian, varicelic, la vaccinul cu virus poliomielitic administrat pe cale orala sau la Fluenz. Raspunsul imun la vaccinul rubeolic a fost modificat in mod semnificativ. Totusi, aceasta modificare poate sa nu prezinte relevanta clinica, avand in vedere ca schema de imunizare impotriva rubeolei consta din doua doze de vaccin rubeolic.
Nu a fost studiata administrarea Fluenz concomitent cu vaccinuri inactivate.
Nu a fost evaluata utilizarea concomitenta a Fluenz cu medicamente antivirale active impotriva virusurilor gripale A si/sau B. Cu toate acestea, avand in vedere potentialul medicamentelor antivirale pentru gripa de a reduce eficacitatea Fluenz, se recomanda sa nu se administreze vaccinul decat dupa un interval de 48 ore de la intreruperea tratamentului antiviral pentru gripa. Administrarea medicamentelor antivirale pentru gripa intr-un interval de 2 saptamani de la vaccinare poate afecta raspunsul la vaccin.
In cazul administrarii concomitente de medicamente antivirale pentru gripa si Fluenz, trebuie evaluata necesitatea revaccinarii pe baza discernamantului clinic.
1.3 Fertilitatea, sarcina si alaptarea
Sarcina
Exista un numar moderat de date privind utilizarea Fluenz la femeile gravide. Nu au existat dovezi de reactii adverse materne semnificative la 138 de femei gravide cu antecedente de vaccinare cu Fluenz, inregistrate intr-o baza de date cu solicitari de asigurari de sanatate din SUA.
Nu s-au inregistrat complicatii sau dezvoltari fetale anormale in cele mai mult de 300 de cazuri raportate in baza de date AstraZeneca privind siguranta administrarii vaccinului la femeile gravide.
Cu toate ca studiile la animale nu au evidentiat efecte toxice nocive directe sau indirecte asupra functiei de reproducere, iar datele obtinute dupa punerea pe piata ofera un anumit grad de siguranta in cazul administrarii necorespunzatoare a vaccinului, Fluenz nu este recomandat in timpul sarcinii.
Alaptarea
Datele disponibile limitate sugereaza ca Fluenz nu se excreta in laptele uman. Cu toate acestea, deoarece exista date limitate pentru a evalua efectele asupra sugarului alaptat si avand in vedere ca unele virusuri sunt excretate in laptele uman, Fluenz nu trebuie utilizat in timpul alaptarii.
Fertilitatea
Nu exista date cu privire la efectele posibile ale Fluenz asupra fertilitatii masculine si feminine.
1.4 Efecte asupra capacitatii de a conduce vehicule si de a folosi utilaje
Fluenz nu are nicio influenta sau are influenta neglijabila asupra capacitatii de a conduce vehicule si de a folosi utilaje.
1.5 Reactii adverse
Rezumat al profilului de siguranta
Datele privind siguranta utilizarii Fluenz se bazeaza pe datele colectate din studiile clinice efectuate cu Fluenz la peste 29000 de copii si adolescenti cu varsta cuprinsa intre 2 si 17 ani, din studii privind siguranta Fluenz ulterioare autorizarii care au inclus peste 84000 de copii si adolescenti cu varsta cuprinsa intre 2 si 17 ani si din date provenite din studii clinice cu Fluenz Tetra (vaccin gripal viu atenuat, cu administrare nazala) care au inclus peste 2000 de copii si adolescenti cu varsta cuprinsa intre 2 si 17 ani. Date suplimentare au fost obtinute dupa punerea pe piata a Fluenz si Fluenz Tetra. In studiile clinice, profilurile de siguranta pentru Fluenz si Fluenz Tetra au fost similare.
Cea mai frecventa reactie adversa observata in studiile clinice a fost congestia nazala/rinoreea.
Lista reactiilor adverse
Frecventele reactiilor adverse sunt raportate dupa cum urmeaza:
Foarte frecvente (≥1/10)
Frecvente (≥1/100 si <1/10)
Mai putin frecvente (≥1/1000 si <1/100) Rare (≥ 1/10000 si < 1/1000)
Foarte rare (<1/10000)
Tulburari ale sistemului imunitar
Mai putin frecvente: reactii de hipersensibilitate (incluzand edem facial, urticarie si reactii anafilactice foarte rare)
Tulburari metabolice si de nutritie
Foarte frecvente: scadere a apetitului alimentar
Tulburari ale sistemului nervos
Frecvente: cefalee
Tulburari respiratorii, toracice si mediastinale
Foarte frecvente: congestie nazala/rinoree Mai putin frecvente: epistaxis
Afectiuni cutanate si ale tesutului subcutanat
Mai putin frecvente: eruptie cutanata tranzitorie
Tulburari musculo-scheletice si ale tesutului conjunctiv
Frecvente: mialgie
Tulburari generale si la nivelul locului de administrare
Foarte frecvente: stare generala de rau
Frecvente: febra Copii si adolescenti
Intr-un studiu clinic controlat cu un comparator activ (MI-CP111), la sugari si copii cu varsta cuprinsa intre 6 si 11 luni a fost observata o frecventa crescuta a spitalizarilor (determinate de orice cauza), intr-un interval de 180 zile de la administrarea ultimei doze de vaccin (6,1% in cazul Fluenz, comparativ cu 2,6% in cazul vaccinului gripal injectabil). Majoritatea spitalizarilor au fost determinate de infectii la nivelul tractului gastrointestinal si tractului respirator care au aparut la mai mult de 6 saptamani dupa vaccinare. Rata spitalizarilor nu a fost crescuta in cazul subiectilor cu varsta de 12 luni si peste, carora li s-a administrat Fluenz. In acelasi studiu, la copii cu varsta cuprinsa ntre 6 si 23 de luni a fost observata o frecventa crescuta a wheezing-ului, intr-un interval de 42 de zile (5,9% in cazul Fluenz, comparativ cu 3,8% in cazul vaccinului gripal injectabil). Frecventa de aparitie a wheezing-ului nu a fost crescuta la subiectii cu varsta de 24 de luni si peste, carora li s-a administrat Fluenz. Utilizarea Fluenz nu este indicata la sugari si copii cu varsta sub 24 de luni (vezi pct. 4.2).
Dupa punerea pe piata a vaccinului Fluenz, au fost raportate cazuri foarte rare de aparitie a sindromului Guillain-Barré si de exacerbare a simptomelor sindromului Leigh (encefalomiopatie mitocondriala).
Raportarea reactiilor adverse suspectate
Raportarea reactiilor adverse suspectate dupa autorizarea medicamentului este importanta. Acest lucru permite monitorizarea continua a raportului beneficiu/risc al medicamentului. Profesionistii din domeniul sanatatii sunt rugati sa raporteze orice reactie adversa suspectata la:
Agentia Nationala a Medicamentului si a Dispozitivelor Medicale din Romania Str. Aviator Sanatescu nr. 48, sector 1
Bucuresti 011478-RO e-mail: adr@anm.ro Website: www.anm.ro
1.6 Supradozaj
Supradozajul cu Fluenz este improbabil datorita formei de prezentare a acestuia ca un pulverizator preumplut. Administrarea unei doze mai mari decat cea recomandata de Fluenz a fost raportata rar iar profilul reactiilor adverse a fost comparabil cu cel observat la doza recomandata de Fluenz.
Proprietati farmacologice
1.7 Proprietati farmacodinamice
Grupa farmacoterapeutica: vaccinuri gripale, virusuri gripale vii, atenuate; codul ATC: J07BB03. Fluenz este un vaccin trivalent care contine antigeni pentru trei tulpini de virusuri gripale, o tulpina
A/(H1N1), o tulpina A/(H3N2) si o tulpina B din linia Victoria. Tulpinile de virus gripal din Fluenz sunt (a) adaptate la rece (ar); (b) sensibile la temperatura (st); si (c) atenuate (at). Ca urmare, acestea se multiplica la nivel rinofaringian si induc imunitate protectoare.
Eficacitate si siguranta clinica
Eficacitatea clinica
Datele privind eficacitatea Fluenz la copii si adolescenti provin din 9 studii controlate, care au inclus un numar de peste 20000 de sugari, copii si adolescenti; aceste studii au fost efectuate in cursul a 7 sezoane de gripa. Patru studii controlate cu placebo au inclus revaccinarea in al doilea sezon.
Fluenz a demonstrat superioritate fata de vaccinul gripal injectabil in 3 studii controlate cu un comparator activ. Vezi Tabelele 1 si 2 pentru un sumar al rezultatelor privind eficacitatea la copii si adolescenti.
Tabel 1 Eficacitatea Fluenz in studii controlate cu placebo efectuate la copii si adolescenti
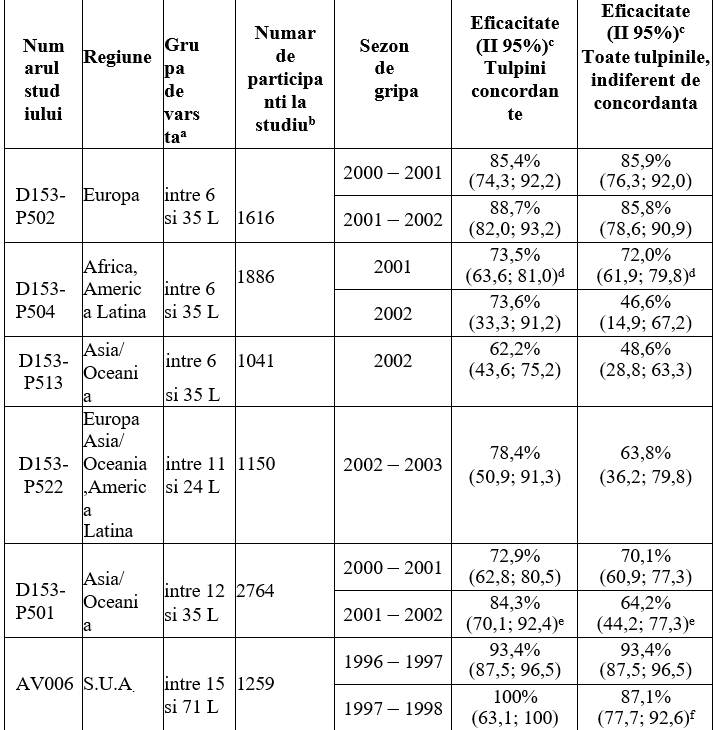
a L = luni
b Numarul de participanti la studiu pentru analiza eficacitatii in anul 1
c Reducerea incidentei bolii gripale, confirmate prin cultura, comparativ cu placebo.
d Pentru studiul clinic D153-P504, datele prezentate se refera la participantii la studiu carora li s-au administrat doua doze din vaccinul studiat. La participantii la studiu nevaccinati anterior, carora li s-a administrat o doza in primul an, eficacitatea a fost de 57,7% (II 95%: 44,7; 67,9), respectiv de 56,3% (II 95%: 43,1; 66,7), demonstrand astfel necesitatea administrarii a doua doze de vaccin la copiii nevaccinati anterior.
e In studiul D153-P501, la participantii carora li s-au administrat 2 doze in primul an si placebo in al doilea an, eficacitatea in al doilea an a fost de 56,2% (II 95%: 30,5; 72,7), respectiv de 44,8% (II 95%: 18,2; 62,9), demonstrand astfel necesitatea revaccinarii in al doilea sezon.
f Principala tulpina circulanta a fost diferita din punct de vedere antigenic de tulpina H3N2 prezenta in vaccin; eficacitatea fata de tulpina neconcordanta A/H3N2 a fost de 85,9% (II 95%: 75,3; 91,9).
Tabel 2 Eficacitatea relativa a Fluenz fata de vaccinul gripal injectabil, in studiile controlate cu un comparator activ, efectuate la copii si adolescenti
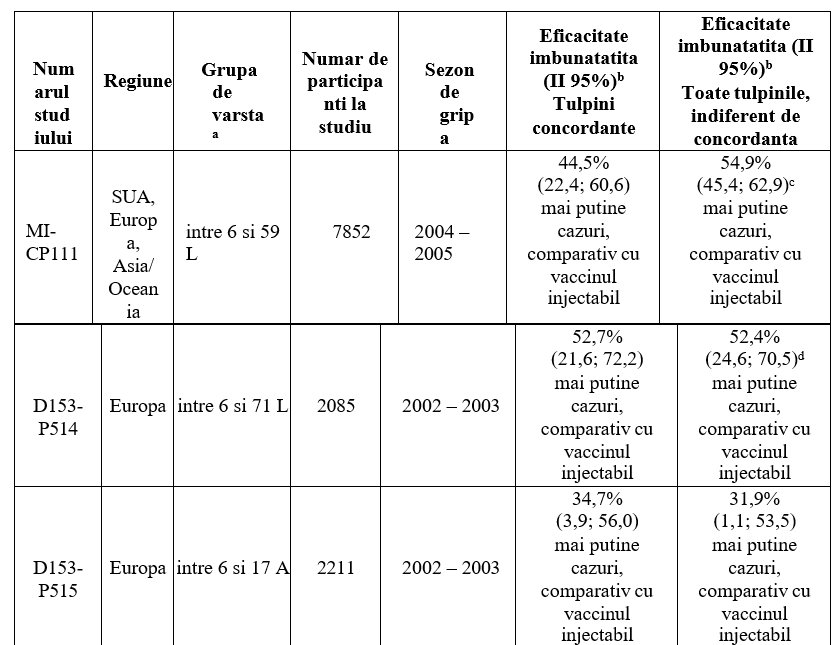
a L = luni. A = ani. Grupa de varsta asa cum a fost descrisa in protocolul studiului.
b Reducerea incidentei bolii gripale, confirmate prin cultura, comparativ cu vaccinul gripal injectabil.
c Fluenz a redus cu 55,7% (39,9; 67,6) numarul de cazuri, comparativ cu vaccinul gripal injectabil, la 3686 de sugari si copii cu varsta cuprinsa intre 6 si 23 de luni si cu 54,4% (41,8; 64,5) numarul de cazuri, la 4166 de copii cu varsta cuprinsa intre 24 si 59 de luni.
d Fluenz a redus cu 64,4% (1,4; 88,8) numarul de cazuri, comparativ cu vaccinul gripal injectabil, la 476 de sugari si copii cu varsta cuprinsa intre 6 si 23 de luni si cu 48,2% (12,7; 70,0) numarul de cazuri, la 1609 de copii cu varsta cuprinsa intre 24 si 71 de luni.
Siguranta clinica
Afectiuni cronice
Desi s-a stabilit profilul de siguranta la copii si adolescenti cu astm bronsic usor pana la moderat, datele provenind de la copii cu alte afectiuni pulmonare sau cu boli cardiovasculare, metabolice sau renale cronice sunt limitate.
Intr-un studiu (D153-P515) efectuat la copii si adolescenti cu varsta cuprinsa intre 6 si 17 ani cu astm bronsic (Fluenz: n=1114, vaccin gripal injectabil trivalent: n=1115), nu au existat diferente semnificative intre grupurile de tratament in ceea ce priveste incidenta exacerbarilor de astm bronsic, a valorii medii a fluxului expirator maxim, a punctajelor simptomelor de astm bronsic sau a punctajelor cu privire la trezirea in cursul noptii. Incidenta whezing-ului la 15 zile de la vaccinare a fost mai mica in cazul persoanelor vaccinate cu Fluenz, in comparatie cu persoanele vaccinate cu vaccinul inactivat (19,5% fata de 23,8%, p=0,02).
Intr-un studiu efectuat la copii si adolescenti cu varsta cuprinsa intre 9 si 17 ani cu astm bronsic moderat pana la sever (Fluenz: n=24, placebo: n=24), criteriul principal de evaluare a sigurantei, modificarea procentuala preconizata a volumului expirator fortat pe secunda (VEF1) masurat inainte si dupa vaccinare nu a variat intre grupurile de tratament.
In studiile efectuate la adulti, dintre care un procent mare au avut o afectiune cronica, profilul de siguranta al Fluenz a fost comparabil cu profilul de siguranta observat la persoanele fara aceste afectiuni.
Persoane imunocompromise
La 24 de copii infectati cu HIV si 25 de copii cu serologie HIV-negativa cu varsta cuprinsa intre 1 si 7 ani, respectiv la 243 de copii si adolescenti infectati cu HIV cu varsta cuprinsa intre 5 si 17 ani aflati sub terapie anti-retrovirala stabilizata, frecventa si durata de raspandire a virusului continut in vaccin au fost comparabile cu cele observate la persoane sanatoase. Nu au fost identificate efecte adverse asupra incarcarii virale sau a numarului de celule CD4 ca urmare a administrarii Fluenz. Douazeci de copii si adolescenti cu imunitatea compromisa usor si moderat cu varsta cuprinsa intre 5 si 17 ani (aflati sub chimioterapie si/sau radioterapie sau care au fost tratati recent cu chimioterapie) au fost randomizati 1:1 intr-un grup de tratament cu Fluenz, respectiv intr-un grup cu administrare placebo. Frecventa si durata raspandirii virusului continut in vaccin la acesti copii si adolescenti imunocompromisi au fost comparabile cu cele observate la copiii si adolescentii sanatosi. Eficacitatea Fluenz in prevenirea infectiilor gripale la persoanele imunocompromise nu a fost evaluata.
Studii la adulti
Mai multe studii controlate cu placebo au aratat ca Fluenz poate avea o anume eficacitate la adulti. Cu toate acestea, nu s-a putut stabili o concluzie cu privire la beneficiul clinic al acestui vaccin la adulti, datorita faptului ca rezultatele observate in unele studii in comparatie cu vaccinuri gripale injectabile au sugerat o eficacitate mai redusa a Fluenz.
1.8 Proprietati farmacocinetice
Nu este cazul.
1.9 Date preclinice de siguranta
Datele non-clinice generate nu au evidentiat niciun risc special pentru om pe baza studiilor conventionale non-clinice privind toxicitatea dupa doze repetate, toxicitatea asupra functiei de reproducere si dezvoltarii, toleranta locala si neurovirulenta.
2. PROPRIETATI FARMACEUTICE
2.1Lista excipientilor
Sucroza
Fosfat dipotasic
Fosfat dihidrogenat de potasiu Gelatina (porcina, de tip A) Clorhidrat de arginina
Glutamat monosodic monohidrat Apa pentru preparate injectabile
2.2 Incompatibilitati
In absenta studiilor privind compatibilitatea, acest medicament nu trebuie amestecat cu alte medicamente.
2.3 Perioada de valabilitate
15 saptamani.
2.4 Precautii speciale pentru pastrare
A se pastra la frigider (2°C – 8°C).
A nu se congela.
A se pastra aplicatorul nazal in ambalajul sau exterior pentru a fi protejat de lumina.
Inainte de utilizare, vaccinul poate fi scos din frigider o singura data pentru o perioada maxima de 12 ore si pastrat la o temperatura care sa nu depaseasca 25°C. Datele de stabilitate indica stabilitatea componentelor vaccinului pentru 12 ore la temperaturi de la 8°C pana la 25°C. La sfarsitul acestei perioade, Fluenz trebuie utilizat imediat sau aruncat.
2.5 Natura si continutul ambalajului
Fluenz este disponibil sub forma de suspensie, in cantitate de 0,2 ml, intr-un aplicator nazal (sticla tip I) de unica folosinta, prevazut cu un varf aplicator (polipropilena cu supapa de transfer din polietilena), capac fara filet pentru protectia varfului aplicator (cauciuc sintetic), piston, dop al pistonului (cauciuc butilic) si un dispozitiv de divizare a dozei.
Marimi de ambalaj cu 1 sau 10 aplicatoare.
Este posibil ca nu toate marimile de ambalaj sa fie comercializate.
2.6 Precautii speciale pentru eliminarea reziduurilor si alte instructiuni de manipulare
Administrare
FLUENZ SE UTILIZEAZA NUMAI PE CALE NAZALA.
- A NU SE UTILIZA CU UN AC DE SERINGA. A nu se injecta.
- A se verifica aspectul vaccinului inaintea administrarii. Suspensia trebuie sa fie incolora pana la galben pal, limpede pana la opalescenta. Pot fi prezente mici particule albe.
- Fluenz se administreaza sub forma de doza divizata in fiecare nara.
- Dupa administrarea unei jumatati de doza intr-o nara, se administreaza cealalta jumatate de doza in cealalta nara, imediat sau la scurt timp dupa.
- Pacientul poate respira normal in timpul administrarii vaccinului – nu este necesara inhalarea activa sau aspirarea (inspirarea) pe nas.
- Vezi diagrama de administrare a Fluenz (Figura 1) pentru instructiuni de administrare detaliate.
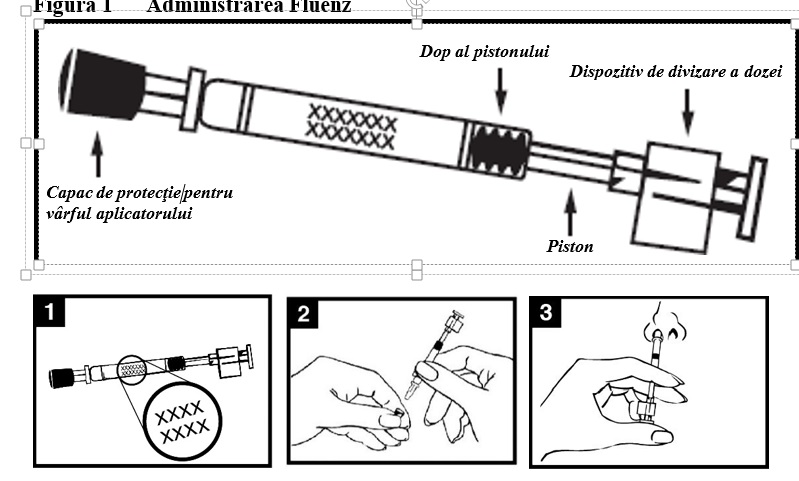
|
Se verifica data de expirare Medicamentul nu trebuie utilizat dupa data de pe eticheta aplicatorului. |
Pregatirea aplicatorului Se indeparteaza capacul de protectie din cauciuc al varfului dispozitivului. A nu se indeparta dispozitivul de divizare a dozei de la celalalt capat al aplicatorului. |
Pozitionarea aplicatorului In timp ce pacientul se afla in pozitie verticala, se introduce varful dispozitivului in interiorul narii pentru a asigura administrarea intranazala a Fluenz. |
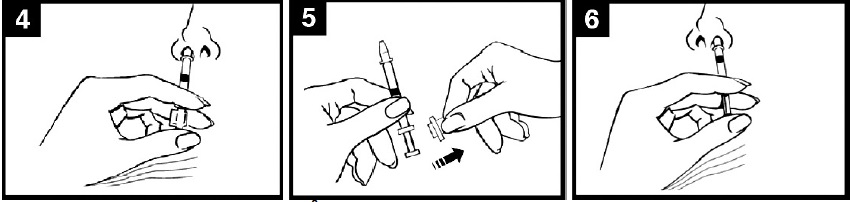
|
Apasarea pistonului A se apasa pistonul printr-o singura miscare, cat mai rapid posibil, pana ce deplasarea acestuia este oprita de dispozitivul de divizare a dozei. |
Indepartarea dispozitivului de divizare a dozei Pentru administrarea in cealalta nara, se prinde dispozitivul de divizare a dozei si se indeparteaza de la nivelul pistonului. |
Administrarea medicamentului in cealalta nara Se introduce varful dispozitivului in interiorul celeilalte nari si se apasa pistonul dintr-o singura miscare, cat mai rapid posibil, pentru a administra restul de vaccin. |
Orice medicament neutilizat sau material rezidual trebuie eliminat in conformitate cu reglementarile
locale privind deseurile medicale.
3.DETINATORUL AUTORIZATIEI DE PUNERE PE PIATA
AstraZeneca AB
SE-151 85 Södertälje Suedia
4. NUMARUL(ELE) AUTORIZATIEI DE PUNERE PE PIATA
EU/1/24/1816/001 Cutie de carton cu deschidere superioara. 1 pulverizator. EU/1/24/1816/002 Cutie de carton cu deschidere superioara. 10 pulverizatoare.
5.DATA PRIMEI AUTORIZARI SAU A REINNOIRII AUTORIZATIEI
Data primei autorizari: 03 iunie 2024
6. DATA REVIZUIRII TEXTULUI 17 iulie 2024
Informatii detaliate privind acest medicament sunt disponibile pe site-ul Agentiei Europene pentru
Medicamente http://www.ema.europa.eu/
Producator: ASTRA ZENECA
*Pentru pret te asteptam in cea mai apropiata farmacie Catena
ARTICOLE RECOMANDATE
-
Informatii complete despre gripa de tip ATimp de citire: 6 minute, 30 secunde16 ianuarie 2025
Gripa este o infectie respiratorie acuta, cauzata de virusurile gripale care circula in toate partile lumii, pe tot parcursul anului. Reprezinta o adevarata povara pentru persoana ce ia virusul, de cele…
-
Rolul vaccinului antigripal in prevenirea complicatiilor respiratorii severeTimp de citire: 4 minute, 59 secunde29 septembrie 2023
Administrarea dozei anuale de vaccin antigripal reprezinta cea mai eficienta modalitate folosita in preventia infectiei cu Influenza. In randul persoanelor sanatoase, cu stare imunitara normala, gripa…
-
Cum functioneaza vaccinul antigripal – ghid simplu si utilTimp de citire: 6 minute, 17 secunde29 septembrie 2023
In fiecare toamna, medicii recomanda ca aproape toti adultii si copiii de peste 6 luni sa fie vaccinati impotriva gripei – inainte sa inceapa sezonul gripei, care de obicei incepe sa se intensifice…
-
Informatii despre vaccinul antigripal in cazul persoanelor cu afectiuni croniceTimp de citire: 6 minute, 40 secunde18 iulie 2024
Vaccinul antigripal reprezinta una din cele mai eficiente metode de prevenire a gripei – o infectie respiratorie de natura virala, extrem de contagioasa, specifica sezonului rece. Desi este considerata…
DESCOPERA PRODUSE
- Medicamente
- Medicamente fertilitate
- Special la Catena
- Idei de cadouri
- Produse de slabit
-
Vitamine, minerale si suplimente
- Vitamine si minerale
- Pentru copii
- Multivitamine
- Stres si somn
- Probiotice
- Memorie
- Imunitate
- Afectiuni cardiovasculare
- Tulburari digestive
- Pentru sportivi
- Regenerare si tonifiere
- Alergii
- Circulatie periferica deficitara
- Diabet
- Infectii urinare
- Raceala si gripa
- Sanatatea femeii
- Antioxidante
- Afectiuni osteoarticulare si musculare
- Ingrijirea si sanatatea ochilor
- ORL
- Frumusete si ingrijire
- Acnee
- Cuplu si sex
- Mama si copilul
- Produse BIO
- Produse naturiste
- Tehnico - medicale
- Diverse
- Alimente cu destinatie speciala
- NOU la Catena
- Nutritie sanatoasa
- Ce Oftapic ti se potriveste
- Adora – Adorabili din prima clipa
CONTACT